目前,肿瘤靶向药物治疗飞速发展,寻找最适患者人群及准确的分子病理学诊断结果成为个体化及靶向治疗取得预期临床效果的重要保障。虽然,我国医疗机构的病理科建设已经取得了长足进步,但仍存在有待提高之处。本期邀请在分子病理学诊断方面具有成熟经验的病理学科专家,为读者解读有关肿瘤个体化治疗中,分子病理学检测需要注意的关键问题。
人表皮生长因子受体2(HER2)作为乳腺癌患者预后指标及曲妥珠单抗治疗的靶点,其检测重要性已经得到临床医生的广泛重视。尽管HER2的检测已有十余年历史,但仍然还存在一些问题。HER2检测准确性直接关系到临床治疗方案的制定,本文将首先介绍乳腺癌HER2检测的现状,再谈谈美国临床肿瘤学会/美国病理学家学会(ASCO/CAP)2013年新发布的关于HER2检测指南的变化,以期为更准确地进行HER2检测及临床治疗提供帮助。
ASCO/CAP在2007年发布HER2检测指南后,我国也于2009年12月发布了新版指南,将HER2检测分为运用免疫组织化学染色(IHC)检测HER2蛋白表达水平和运用原位杂交检测HER2基因扩增状态两部分。
1、Her-2蛋白检测
一个准确的检测结果不仅受检测方法影响,同时受样本处理、所用试剂和结果判读三方面的影响,只有将这三方面同时做好,才能得到满意的结果。
标本处理
穿刺或切除后的乳腺癌组织应在1小时内固定,组织较大时应每隔5~10mm切开,用纱布或滤纸将相邻组织片分开,以确保固定液充分渗透和固定。固定液的量应为组织体积的10倍,固定时间以6~48小时为宜,此组织标本可以作为理想的免疫组织化学染色(IHC)、荧光原位杂交(FISH)和显色原位杂交法(CISH)检测和分析的对象,该过程的完成需要临床医生的积极配合。
结果判读标准
目前一些大医院使用全自动IHC仪器进行蛋白的检测,只要初始做好内外部质控,重复性也较好。结果判读的相应标准(按每张切片计算)如下:“0”为无着色;“l+”为任何比例的浸润癌细胞呈现微弱、不完整的细胞膜着色;“2+”为>10%的浸润癌细胞呈现弱至中等强度、完整但不均匀的细胞膜棕黄着色或<30%的浸润癌细胞呈现强且完整的细胞膜棕褐着色;“3+”为>30%的浸润癌细胞呈现强的、完整的细胞膜棕褐着色。
Her-2蛋白表达3+者可作为临床医生建议患者接受曲妥珠单抗等药物治疗的依据;2+者须进一步应用FISH或CISH等方法行HER2基因扩增状态检测(但仍可能出现结果不能确定的情况),或重复IHC进一步检测,也可选取不同组织块重新检测或送有质量保证的实验室进行检测。
总体来说,现在Her-2蛋白的检测相对较稳定,结果的重复性也较好。
ASCO/CAP2013指南中的新变化
指南中对于蛋白检测变化有两点:①样本固定时间从原来的6~48小时改为6~72小时,这样对于周五得到的标本,用足量的固定液固定,到周一取材也可以;②将Her-2蛋白3+的判读标准从原来的“>30%的浸润癌细胞呈现强的、完整的细胞膜棕褐着色”调整到“>10%的浸润癌细胞呈现强的、完整的细胞膜棕褐着色”,这对于具有异质性的肿瘤样本判读很重要。
2、HER2基因的扩增检测
FISH检测
HER2基因扩增检测前对于样本的处理要求大致也同IHC检测,检测使用的方法主要是FISH。
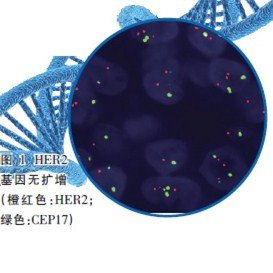
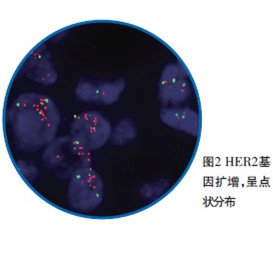
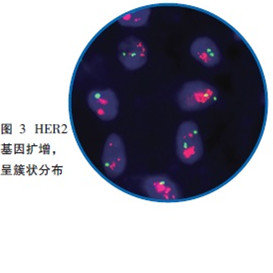
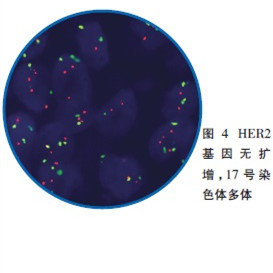
FISH是常用的分子病理学技术,各单位方法可能稍有差别,目前进行HER2基因状态检测的探针绝大部分是同时含有HER2基因和该基因所在17号染色体着丝粒(CEP17)的混合探针。
指南对HER2基因检测的结果提出了总体要求:杂交后组织细胞中≥75%的细胞核呈现出双色信号,视为检测成功,且橘红色、绿信号互为对照,癌与非癌细胞互为对照。
FISH检测的结果判读